The Plant Cell丨中国农业大学小麦研究中心揭示小麦热胁迫响应新机制
2023 年 7 月 3 日,中国农业大学小麦研究中心在 The Plant Cell 杂志上在线发表了题为 "Thermosensitive SUMOylation of TaHsfA1 defines a dynamic ON/OFF molecular switch for the heat stress response in wheat" 的研究论文。
小麦是世界三大粮食作物之一,满足了世界人口 20% 的能量需求。小麦是典型的喜凉作物,对高温尤为敏感。随着温室效应加剧,全球平均气温升高,高温极端天气频发,严重制约了小麦产量的稳定性。HsfA1s 作为热胁迫响应 (heat stress responses, HSRs) 转录调控网络的核心调控元件,在生物响应和适应热胁迫生长环境中发挥着不可或缺的调节作用。经典的 HSRs 分子模型认为:在正常温度下,一些热激蛋白 (如 HSP70 和 HSP90) 能够与 HsfA1 结合形成多蛋白抑制复合体,从而抑制 HsfA1 的活性,避免 HSRs 的错误发生;在遭遇热胁迫时,HsfA1 立即从多蛋白抑制复合体中解离出来并迅速激活下游 HSRs,以适应短期热胁迫。然而,在长期热胁迫环境下,植物需要对 HsfA1 的蛋白活性进行精准控制,使 HSRs 能够适时“降温”和“刹车”,避免持续的 HSRs 对植物产生过度伤害。然而在植物中,如何及时“回收”激活状态的 HsfA1 以及如何精准调节 HSRs 的强度,仍然是未解之谜。从分子水平深入解析植物 HsfA1 蛋白在热胁迫响应不同阶段的生化功能变化,有助于深化对小麦 HSRs 转录调控分子网络模型的系统认知,同时也有望为设计低热敏感型稳产小麦新种质、降低小麦在干热风危害中的产量损失提供理论依据。
1. TaHsfA1是小麦基础耐热性必需的核心调控因子
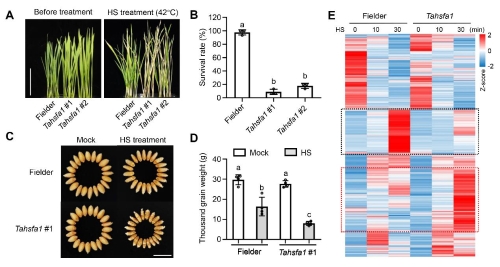
为了探究小麦HSRs的精细调控模式,同源克隆了小麦TaHsfA1基因的编码序列。同时,利用基因编辑技术创制了TaHsfA1功能缺失的突变体材料Tahsfa1-KO(#1,#2)。在适宜生长温度下,Tahsfa1-KO材料未出现明显的发育缺陷表型;而在苗期和乳熟早期进行热处理发现,Tahsfa1-KO相较于野生型表现为高度的热敏感性。其中,苗期热处理后,Tahsfa1-KO存活率显著低于野生型;乳熟早期热处理后,Tahsfa1-KO种子明显干瘪且千粒重显著低于野生型(图1 A-D)。RNA-Seq数据显示,与野生型相比,热处理后的Tahsfa1-KO有大量热响应相关基因的表达出现异常(图1E)。上述结果证明,TaHsfA1在小麦响应热胁迫和保持其基础耐热性中发挥非常重要的作用,是小麦HSRs转录调控网络的核心组分。
图1 TaHsfA1是小麦耐热必需的核心调控因子
2. TaHsfA1蛋白受到SUMO化修饰,持续高温抑制这种修饰
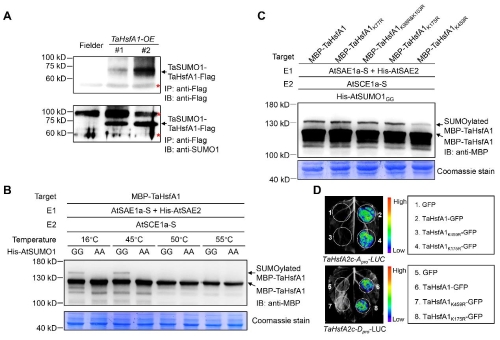
通过酵母双杂交筛选得到一系列可能与TaHsfA1蛋白相互作用的候选蛋白,包括TaSUMO1(small ubiquitin like modifier)、TaHAG1(histone acetyltransferase)、TaSLT1(sodium- and lithium-tolerant 1)等。前人研究表明,SUMO化修饰参与HSRs调控,因此,研究人员选择TaSUMO1进行后续研究。结果表明,TaHsfA1蛋白能够与TaSUMO1共价结合,发生SUMO化修饰,并且这一修饰主要发生在第459位Lys氨基酸残基(图2 A-C)。进一步研究发现,在持续高温条件下,TaHsfA1的SUMO化修饰水平显著降低并最终消失(图2B),说明TaHsfA1的SUMO化修饰存在热敏感的特点。
图2 TaHsfA1的SUMO化修饰及对TaHsfA1转录激活活性的影响
3. TaHsfA1 Lys459位SUMO修饰影响TaHsfA1的转录激活活性
为了评价Lys459位SUMO化修饰的生物学意义,对不同修饰状态的TaHsfA1蛋白的稳定性、DNA结合活性以及转录激活活性等进行了分析。结果证明,Lys459位的SUMO化修饰不影响TaHsfA1的蛋白稳定性和DNA结合活性,但对TaHsfA1的转录激活活性产生重要影响(图2D)。
综合以上结果,我们证明TaHsfA1在Lys459位发生SUMO化修饰,这一修饰是TaHsfA1的转录激活活性所必须的;在发生持续高温胁迫时,TaHsfA1 Lys459位的SUMO化修饰水平受到显著抑制,降低了TaHsfA1的转录激活活性,实现了TaHsfA1的及时“回收”以及下游HSRs的“刹车”。
4.结论与讨论
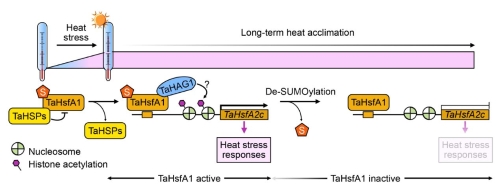
研究人员提出了热胁迫下TaHsfA1的SUMO化修饰作为蛋白活性分子开关的“ON-OFF”模型:正常温度下,SUMO化修饰的TaHsfA1与TaHSPs结合,其转录活性被抑制;热胁迫初期,TaHsfA1从HSP蛋白复合物中解离并结合到下游靶标基因启动子上,SUMO化修饰的TaHsfA1更易招募TaHAG1并激活下游HSRs;持续热胁迫下,TaHsfA1的SUMO化水平降低,TaHsfA1由活性状态转变为非活性状态,从而导致HSRs减弱甚至关闭,有助于小麦建立对持续热胁迫生长环境的适应性(图3)。
图3 TaHsfA1活性ON-OFF分子模型
中国农业大学农学院小麦研究中心 刘杰 副教授为该论文通讯作者。博士研究生 王浩然、已毕业博士生 冯曼 (现为华中农业大学博士后) 和博士研究生 蒋钰婕 为论文共同第一作者。中国农业大学 孙其信 教授、彭惠茹 教授、倪中福 教授、姚颖垠 教授、辛明明 教授、郭伟龙 副教授对该工作进行了指导和帮助。研究得到国家自然科学基金项目 (31991214 和 32072055) 和 中国农业大学 2115 人才培育发展支持计划的资助。